Cómo Registrar Productos Veterinarios Extranjeros en Egipto


Contenido
Categorías de Registros de Productos Veterinarios en Egipto

- Aditivos para Piensos o Suplementos Nutricionales
- Medicamentos Veterinarios
- Desinfectantes Veterinarios
- Vacunas Veterinarias
Requisitos de Registro para Alimentos Veterinarios/Suplementos Nutricionales en Egipto

Aunque se encuentra bajo las mismas pautas y proceso general que los productos farmacéuticos veterinarios, a menudo implica menos requisitos de documentos técnicos. La guía detallada para el registro de aditivos alimentarios o suplementos nutricionales veterinarios en Egipto se puede encontrar aquí: El proceso asegura que todos los productos cumplan con los estándares de seguridad, calidad y nutrición necesarios para el consumo animal.
1. Presentación del Dossier:
El proceso de presentación comienza con la entrega de un dossier que contenga lo siguiente:
- Composición del Producto: Información detallada sobre los ingredientes, incluidos los componentes activos, excipientes y sus fuentes.
- Proceso de Fabricación: Descripción completa de cómo se produce el aditivo alimentario o suplemento, incluidos los puntos de control de calidad y los protocolos de seguridad.
- Datos de Eficacia Nutricional: Documentación que respalde la eficacia del producto para mejorar la salud o la nutrición animal.
- Datos de Seguridad: Estudios y análisis que demuestren la seguridad del producto para el consumo animal, incluidos los posibles efectos secundarios o niveles de toxicidad.
- Certificado de Libre Venta (FSC): Verifica que el producto se venda legalmente en su país de origen.
- Certificado de No OGM: Si corresponde, este certificado asegura que el producto no contiene organismos genéticamente modificados.
Se deben enviar muestras del producto al Laboratorio Central para Alimentos y Aditivos Animales para realizar pruebas exhaustivas. Las pruebas de laboratorio buscan verificar que el producto cumpla con los estándares egipcios para alimentos para animales, asegurando que sea seguro y beneficioso para el consumo animal.
Las pruebas realizadas pueden incluir:
- Análisis Nutricional: Verificar que el producto proporcione los beneficios nutricionales declarados.
- Pruebas de Contaminantes: Comprobar la presencia de sustancias nocivas como metales pesados, pesticidas o contaminantes microbianos peligrosos.
El MOA exige que todos los aditivos alimentarios y suplementos cumplan con estrictos estándares de embalaje y etiquetado. Las etiquetas deben incluir:
- Detalles de la Composición: Listado de todos los ingredientes y sus cantidades.
- Instrucciones de Uso: Orientación clara sobre cómo debe administrarse o mezclarse el producto con el alimento para animales.
- Advertencias de Seguridad: Precauciones o riesgos asociados con el uso del producto.
- Reclamaciones Nutricionales: Las afirmaciones sobre los beneficios del producto deben estar respaldadas por pruebas científicas.
- Tras las pruebas exitosas y la revisión del dossier, el MOA emitirá un Certificado de Registro para el aditivo alimentario o suplemento, permitiendo su venta y distribución en Egipto.
- Este certificado suele tener una vigencia de 5 a 10 años, según el tipo de producto, tras lo cual se requiere renovación.
Plazo Estimado: El proceso generalmente toma de 6 a 9 meses, dependiendo de la preparación del dossier y el tiempo requerido para las pruebas de laboratorio.
SIMPLIFICAR EL REGISTRO
Requisitos de Registro para Medicamentos Veterinarios en Egipto

El registro de medicamentos veterinarios en Egipto sigue un proceso estructurado y en varios pasos destinado a garantizar la seguridad, eficacia y cumplimiento con las Buenas Prácticas de Manufactura (GMP). A continuación, se detallan los pasos del proceso:
1. Requisitos Previos al Registro:
- El solicitante (generalmente un fabricante o distribuidor local) debe tener una cuenta registrada con la Autoridad Egipcia de Medicamentos (EDA).
- Todos los sitios de fabricación deben cumplir con GMP y contar con la documentación adecuada para demostrar su cumplimiento.
2. Presentación del Dossier:
- Archivo Maestro del Sitio (SMF): Este documento proporciona información completa sobre la instalación de fabricación, incluyendo personal, equipo, diseño y medidas de control de calidad.
- Certificado de Buenas Prácticas de Manufactura (GMP): Un certificado válido emitido por una autoridad reconocida que confirme que el sitio de fabricación cumple con los estándares de GMP.
- Información del Producto: Una descripción detallada de la composición del producto, ingredientes activos, excipientes y método de fabricación. También debe incluir Datos Farmacológicos, Datos de Estabilidad, Eficacia Clínica, Estudios de Toxicidad y Protocolos de Control de Calidad.
- Certificados como el Certificado de Libre Venta (FSC) y el Certificado de Producto Farmacéutico (CPP).
3. Revisión Científica y Administrativa:
- El dossier es revisado por el comité científico de la EDA. Evaluarán la seguridad, eficacia, medidas de control de calidad del producto y su cumplimiento con los estándares locales e internacionales.
- El proceso puede incluir solicitudes de información adicional o aclaraciones, dependiendo de la complejidad del producto y la integridad del dossier.
4. Pruebas de Muestras y Análisis:
- Se deben enviar muestras del producto a un laboratorio aprobado por la EDA para su análisis. Las pruebas de laboratorio se centran en garantizar que el producto cumpla con las especificaciones proporcionadas en el dossier, incluidas la potencia, pureza y estabilidad del producto.
- Los resultados de este análisis contribuirán a la decisión final sobre la aprobación del producto.
5. Aprobación y Emisión del Certificado de Registro:
- Si la EDA está satisfecha con el dossier y los resultados de las pruebas de laboratorio, emitirá un Certificado de Registro de Producto Veterinario, permitiendo que el producto se comercialice y distribuya en Egipto.
- El certificado de registro suele tener una validez de 10 años, tras lo cual se requiere renovación.
Plazo Estimado: El proceso completo generalmente toma entre 6 y 12 meses, dependiendo de la complejidad del producto y de la integridad de la presentación inicial del dossier.
OPTIMIZAR EL REGISTRO
Requisitos de Registro para Desinfectantes Veterinarios en Egipto

Este proceso asegura que todos los desinfectantes cumplan con los estándares de seguridad y eficacia para la salud animal y humana. La guía detallada para el registro de desinfectantes veterinarios en Egipto se puede encontrar aquí: 1. Presentación del Dossier:
Los documentos requeridos incluyen:
- Composición del Producto: Fórmula detallada e ingredientes activos.
- Proceso de Fabricación: Descripción completa del proceso de producción.
El archivo de registro debe ser subido a la plataforma en línea de la EDA, acompañado de las tarifas y la documentación requerida.
2. Etiquetado y Embalaje:
Las etiquetas deben cumplir con los estándares egipcios, especificando instrucciones de uso, advertencias de seguridad y lista de ingredientes en árabe y cualquier otro idioma requerido.
3. Pruebas de Muestras:
Se deben enviar muestras del desinfectante para pruebas de laboratorio para asegurar que cumplan con los estándares de seguridad y eficacia. Los desinfectantes deben demostrar efectividad contra microorganismos objetivo y cumplir con todos los requisitos regulatorios para entornos veterinarios.
4. Aprobación:
La solicitud es revisada por un comité especializado. Tras una evaluación exitosa, se otorga una Licencia de Registro, válida por 10 años.
5. Aprobación Preliminar para Nuevos Productos:
Se emite una aprobación preliminar para nuevos productos, lo que permite a los fabricantes producir y probar lotes localmente bajo condiciones controladas. Para productos importados, se deben presentar estudios de estabilidad y muestras para su verificación.
6. Renovación y Extensión:
Los productos deben ser registrados nuevamente antes de la expiración de los 10 años. El re-registro es obligatorio cada 10 años, con datos adicionales de estabilidad y posibles pruebas de muestras durante la revalidación. Si se necesita más tiempo para completar los requisitos, se puede otorgar una extensión.
Consideraciones Clave para el Registro de Desinfectantes
- Datos de Toxicidad: Los desinfectantes deben proporcionar informes completos de toxicidad para demostrar su uso seguro en entornos veterinarios.
- Impacto Ambiental: Si corresponde, se deben evaluar los posibles efectos del producto en el medio ambiente, como la toxicidad residual.
Requisitos de Registro para Vacunas Veterinarias en Egipto
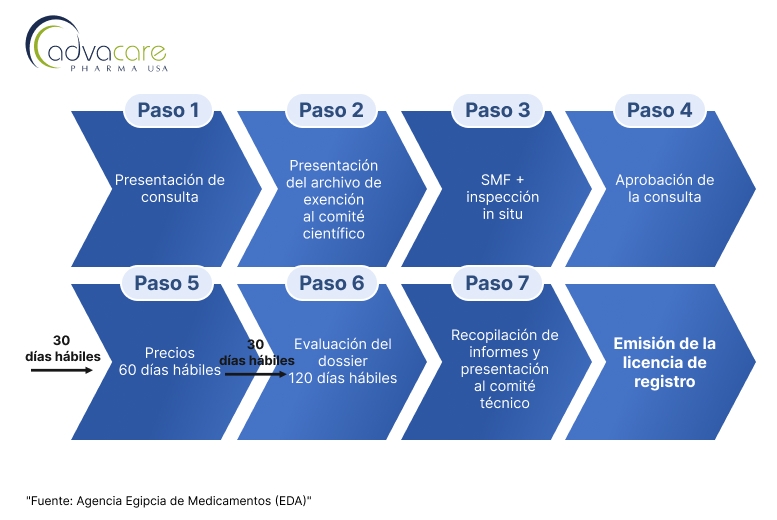
Los distribuidores que deseen registrar productos terminados de vacunas veterinarias extranjeras, particularmente de orígenes no referentes, pueden seguir los pasos descritos en el Proceso B del artículo resumido en el siguiente diagrama de flujo:
1. Presentación de la Consulta de Solicitud:
El solicitante presenta una consulta de solicitud para la aprobación de la consulta. Se le pedirá al solicitante que contacte con la unidad de examen del expediente científico para presentar un archivo de exención dentro de los 20 días hábiles o la consulta será cancelada.
2. Presentación de Documentos del Sitio e Inspección en el Lugar:
Después de la aprobación del comité científico especializado en productos biológicos, el solicitante debe presentar el archivo maestro del sitio (SMF) para que sea evaluado por el departamento de inspección biológica. En caso de aprobación del SMF presentado, el departamento de inspección inspeccionará el sitio para verificar el cumplimiento de las GMP. Los inspectores evaluarán si el sitio cumple con los estándares de GMP y las normativas locales egipcias.
3. Presentación del Dossier:
Tras la aprobación del cumplimiento de las GMP en el sitio de fabricación, el solicitante debe presentar un dossier completo. El dossier debe incluir:
- Composición del Producto: Información detallada sobre los ingredientes activos e inactivos de la vacuna.
- Proceso de Fabricación: Un esquema claro del proceso de fabricación, incluyendo detalles sobre las materias primas y las medidas de control de calidad.
- Datos de Estabilidad: Estudios de estabilidad que demuestren que la vacuna mantiene su eficacia durante su vida útil.
- Datos de Seguridad y Eficacia: Resultados de ensayos clínicos, a menudo incluyendo estudios locales para demostrar que la vacuna es eficaz y segura en las poblaciones animales de Egipto.
- Certificación GMP: Certificación del sitio de fabricación de la vacuna que demuestre el cumplimiento de las Buenas Prácticas de Manufactura (GMP).
- Certificado de Libre Venta (FSC) o equivalente, que demuestre que la vacuna está aprobada para su venta en su país de origen.
- Se deben enviar muestras de la vacuna a un laboratorio aprobado para realizar pruebas de control de calidad. Las pruebas verifican típicamente la potencia, seguridad y cumplimiento de las especificaciones del dossier.
- Las vacunas pueden someterse a ensayos de eficacia locales si el MOA lo requiere para demostrar su efectividad en condiciones locales.
- El etiquetado y el embalaje deben cumplir con las normativas egipcias. Esto incluye garantizar que la etiqueta contenga las instrucciones adecuadas, advertencias e información del lote en árabe y en cualquier otro idioma requerido.
- Tras la finalización exitosa de la revisión del dossier y las pruebas de laboratorio, GAVS emitirá un Certificado de Registro de Vacunas, permitiendo que la vacuna sea comercializada y vendida en Egipto.
- El certificado de registro generalmente necesita ser renovado periódicamente, y la renovación a menudo requiere datos de estabilidad actualizados y posiblemente nuevas pruebas de muestras.
- El proceso puede tomar de 9 a 12 meses, dependiendo de la complejidad de la vacuna, la integridad del dossier y cualquier prueba o inspección de sitio requerida.
REGISTRO ACELERADO
Simplificando el Proceso de Registro con AdvaCare Pharma

Pasar por el complejo proceso de registro de productos veterinarios extranjeros en Egipto requiere una comprensión profunda de las regulaciones específicas de cada país, desde la presentación del dossier hasta las pruebas locales y la vigilancia post-comercialización. Asociarse con una empresa experimentada como AdvaCare Pharma, que cuenta con amplia experiencia en la región, garantiza un proceso de registro más fluido y eficiente. Con nuestra experiencia y servicios personalizados, le ayudamos a superar los desafíos regulatorios y a registrar con éxito sus productos veterinarios en todo el Medio Oriente.
Es importante que los distribuidores trabajen con fabricantes que puedan brindar el máximo apoyo técnico en este proceso altamente complejo.
¿Cómo Hacemos que los Registros Sean Más Fáciles?
- Preparación y Autenticación de Documentos Simplificada AdvaCare Pharma garantiza que todos los documentos del sitio, incluidos el Archivo Maestro del Sitio (SMF) y los certificados GMP, estén siempre actualizados y listos para su presentación. Esto permite un inicio rápido en el proceso de registro del sitio. Priorizamos el proceso de autenticación y, con la confirmación del distribuidor, nos aseguramos de que los documentos correctos sean legalizados de inmediato, minimizando retrasos y evitando costos innecesarios debido a la tramitación de documentos incorrectos.
- Experiencia en Revisión GMP e Inspecciones de Sitio AdvaCare Pharma ha superado con éxito múltiples revisiones GMP e inspecciones de sitio en toda la región, cumpliendo con los altos estándares esperados por las autoridades locales. Nuestras instalaciones de producción mantienen estrictas medidas de control de calidad, garantizando el cumplimiento de los requisitos regulatorios. Desde la facilitación de solicitudes de visa hasta la orientación de los inspectores durante las visitas al sitio, AdvaCare Pharma gestiona eficientemente todo el proceso de inspección, proporcionando una experiencia fluida tanto para los distribuidores como para los inspectores.
- Presentación de Dossiers Completa y de Alta Calidad En AdvaCare Pharma, damos prioridad a la calidad y el cumplimiento en cada presentación de dossier. Nuestro equipo técnico experimentado se asegura de que cada dossier esté adaptado para cumplir con los requisitos específicos del país donde se presenta el registro. Al recopilar exhaustivamente todas las referencias internas y externas necesarias antes de comenzar el proceso de registro, minimizamos las posibilidades de solicitudes adicionales o rechazos por parte de las autoridades locales, haciendo que el proceso de revisión sea más fluido y rápido.
- Empaque Personalizado y Calidad de Muestras El empaque es un elemento crítico en el registro de productos, y AdvaCare Pharma va más allá para asegurar que cumpla con los estándares locales. Colaboramos estrechamente con nuestros distribuidores para diseñar y producir el arte del empaque que cumpla con las normativas locales. Nuestras muestras se fabrican de acuerdo con los requisitos de registro para garantizar la más alta calidad, alineándose con las rigurosas pruebas y evaluaciones de cada país. Este enfoque garantiza que nuestros productos cumplan con todos los estándares locales, facilitando un proceso de registro exitoso y eficiente.
AdvaCare Pharma comprende las complejidades de navegar por los rigurosos requisitos de registro para productos veterinarios. Con varios productos ya registrados en la región del CCG y en más de 65 países en todo el mundo, ofrecemos un camino simplificado y confiable hacia el éxito en el mercado. Nuestro compromiso con la excelencia regulatoria, junto con soluciones personalizadas de soporte y empaque, garantiza que su proceso de registro sea fluido y eficiente.
Únase hoy a nuestra red global de distribuidores de confianza. Como socio de AdvaCare Pharma, los distribuidores se beneficiarán de asistencia regulatoria y técnica integral, asegurando un acceso más rápido al mercado para productos de alta calidad y asequibles. También ofrecemos beneficios exclusivos para distribuidores, incluidos soporte de marketing completo, capacitación de productos y recursos de ventas para ayudar a hacer crecer su negocio. Con un compromiso con asociaciones sólidas, estamos dedicados a su éxito a largo plazo. Visite nuestro sitio web y solicite ser distribuidor para obtener una ventaja competitiva en su región.
Referencias: EDA 2024 "EDA" EDA 2023 "Guía de Procedimientos de Registro de Productos Farmacéuticos Veterinarios" EDA 2023 "Guía y Normas Regulatorias para el Registro de Antisépticos/Desinfectantes" EDA 2023 "Guía para el Registro de Productos Biosimilares en Egipto" MEVMAS 2024 "Conferencia de Medicina Veterinaria y Ciencia Animal en Medio Oriente"
¿No quiere perderse el próximo artículo de AdvaCare?

Contenido recomendado

Etiqueta Blanca vs Marca Privada vs Distribución: ¿Qué es Mejor para Negocios de Suplementos?


Proceso de Fabricación de Suplementos


Cómo Registrar Productos Veterinarios Extranjeros en Medio Oriente
